CONFERENCIA INAUGURAL
TRATAMIENTO ESPECÍFICO DE LA ALERGIA A HONGOS AERÓGENOS: RINITIS Y ASMA POR
ALTERNARIA
Extractos alergénicos de Alternaria tenuis para
diagnóstico y tratamiento
A. Martínez, J. A. Asturias, J. Pineda, M. T. Lizaso*, B. E.
García*, S. Echechipía*, E. Lasa*, M. Anda*, A. I. Tabar*.
Bial-Arístegui, Departamento de I+D, Bilbao.
(*) Hospital Virgen del Camino, Pamplona.
.
Introducción
Alternaria tenuis, o su sinónimo A. alternata es un hongo filamentoso que
tiene distribución mundial, siendo un saprofito muy común que se encuentra en plantas,
alimentos, textiles y en diferentes tipos de suelos. Forma colonias de color negro o
negro-oliváceo. Sus esporas o conidios tienen una forma muy típica ovoide o elipsoidal
(con forma de pera), con un tamaño de 18 a 80 micras de longitud y de 7 a 18 de ancho.
Tiene un patrón estacional, apareciendo sobre todo cuando el tiempo es cálido y húmedo,
alcanzando sus máximas concentraciones a finales de verano.
Por su origen, Alternaria debe ser considerado un aeroalergeno de exterior con una abundancia relativamente grande en el aire, pero que también está presente en los hogares en las que constituye una de las principales fuentes de alergenos fúngicos, creciendo sobre paredes húmedas, marcos de ventanas y alimentos. Así las típicas manchas negras que aparecen sobre zanahorias, cebollas y tomates son debidas al crecimiento de dicho moho.
Desde el punto de vista alergénico, es innegablemente una de las más importantes fuentes alergénicas de origen fúngico. Pese a estar en concentraciones en aire inferiores a Cladosporium, su relevancia clínica es similar (Nilsson S. y cols. 1984). Aunque la prevalencia de la sensibilización a Alternaria no se ha definido con precisión, hay estudios, por ejemplo en población norteamericana (Gergen P.J. y cols. 1987) que detectan una prevalencia, en prueba cutánea del 3,6%
(sobre un total de pacientes positivos a aeroalergenos), siendo positiva en un 70% de los pacientes con alergia a hongos. También se ha demostrado que la sensibilización a A. alternata es un factor de riesgo de asma severa y, que por tanto, constituye un problema clínico de importancia. En un estudio realizado en un área climática similar a la nuestra –Italia- se han obtenido valores del 10% (Corsico y cols., 1998). Y, finalmente, en un estudio multicéntrico europeo (D'Amato G. y cols, 1997), se encontraron prevalencias que oscilaron entre el 3% de Portugal y el 20% de España (Murcia).
Actualmente se tiene un buen conocimiento de los alergenos de A. tenuis. En la ultima versión de la web (www.allergen.org/List.htm) del Sub-comité de nomenclatura de alergenos de la IUIS (International Union of Immunological Societies) se registran 9 alergenos diferentes (Tabla I). Sin lugar a dudas, el más relevante es Alt a 1, con una prevalencia de sensibilización entre el 80 y 100% (según estudios). Es por tanto, el alergeno prioritario a valorar en inmunoterapia. Es una proteína de 28/30 kDa con dos subunidades de 14,5 y 16 kDa de peso molecular aparente (De Vouge y cols., 1996).
También presenta carácter de alergeno mayor Alt a 2, una proteína de 25 kDa, cuyo peso molecular ha sido redefinido en un reciente estudio en el que se describe su clonación (Bush RK y cols. 1999).
Tabla IAlergenos de A. alternata registrados en la base de datos de la IUIS (marzo 2000)
Alérgeno |
Identificación |
Pm (kDa) |
Prevalencia (%)* |
|
- |
28-30 |
82 1-100 2 |
|
- |
25 |
613 |
|
Proteína de choque térmico | 70 |
- |
|
Disulfuro isomerasa | 57 |
- |
|
Proteína P2 ribosomal ácida | 11 |
8 4 |
|
Proteína YCP4 | 22 |
7 4 |
|
Aldehído deshidrogenasa | 53 |
2 4 |
|
Enolasa | 45 |
- |
|
Proteína P1 ribosomal ácida | 11 |
- |
La alta variabilidad biológica de las materias primas utilizadas para la fabricación de extractos de Alternaria para uso diagnóstico y terapéutico ha ocasionado frecuentemente la utilización de productos poco reproducibles y eficaces, lo que ha dificultado, hasta el presente, el establecimiento de una inmunoterapia apropiada. El objetivo del presente estudio fue el de obtener un extracto bien definido, caracterizado y reproducible con el que realizar un ensayo clínico de seguridad y eficacia en pacientes hipersensibles a A. alternata o tenuis.
Obtención de un extracto adecuadoDentro de la fase de obtención de un extracto fúngico adecuado, la primera tarea que se llevó a cabo fue la de seleccionar la fuente alergénica más idónea.
Con el objetivo de caracterizar y estandarizar biológicamente la producción de extractos óptimos de A. alternata para inmunoterapia, se diseñó un procedimiento de obtención basado en los siguientes aspectos:
La tabla II se muestra el rendimiento obtenido tras el proceso de obtención de los tres tipos de extractos para cada una de las 4 cepas cultivadas. Se apreciaron notables diferencias cuantitativas, fruto de la variabilidad anteriormente mencionada, pues se obtuvieron rendimientos claramente diferenciados, según cepa y origen alergénico, oscilando entre un mínimo de 50 y un máximo de 1102 mg/ml. En todos los casos se obtuvo el mayor rendimiento en los extractos FC.
Tabla II
Rendimiento alergénico (mg extracto liofilizado/l cultivo) de las diferentes cepas de A. alternata.
CEPA |
ORIGEN |
FC |
EP |
ME |
106.24 |
CBS |
226 |
154 |
118 |
60378 |
CBS |
253 |
250 |
50 |
93039 |
CBS |
1102 |
64 |
335 |
MR-3292 |
IMIM |
415 |
115 |
160 |
CBS: Centralbureau Voor Schimmel Cultures
IMIM: Instituto Municipal de Investigaciones Médicas, Barcelona
Los extractos obtenidos con las diferentes cepas fueron combinados para conformar finalmente los 3 lotes (FC, EP y ME) que se evaluaron cualitativamente a nivel de componentes proteicos (mediante electroforesis SDS-PAGE) y de alergenos o proteínas fijadoras de IgE (SDS-PAGE immunoblotting).
Estas técnicas evidenciaron que el extracto de filtrado de cultivo (FC), conteniendo los antígenos metabólicos, era el que presentaba un mayor número de componentes proteicos, mejor resueltos, y la mayor reactividad fijadora de IgE, tanto en el global de la calle del immunoblotting, como en el de cada banda considerada individualmente. Asimismo, el extracto de FC mostró la mayor intensidad fijadora de IgE en la banda correspondiente al alergeno mayor Alt a 1 (masa molecular aparente a 16/17 kDa).
La actividad alergénica de los tres extractos fue evaluada in vivo mediante pruebas cutáneas de Prick. Se utilizaron 4 concentraciones de cada extracto (0,5; 1; 2 y 5 mg/ml). La referencia positiva utilizada fue de histamina (dihidrocloruro) a 10 mg/ml. Fueron incluidos en el estudio 20 pacientes con clínica de alergia a A. alternata, IgE específica y prueba cutánea positiva.
La recta de actividad se construyó representando el logaritmo de la concentración utilizada en Prick frente al área de la pápula originada (medida por digitalización). El valor SPT (Skin Prick Test), definido como la concentración de cada extracto que originó una pápula equivalente a la de histamina. El extracto FC mostró, con diferencia, la mayor reactividad cutánea. En los otros dos extractos, el valor SPT hubo de ser estimado por extrapolación. La relación de valores SPT entre los tres extractos fue de 1:4:132 (FC:EP:ME).
En vista de los resultados anteriormente descritos se seleccionó el extracto de filtrado de cultivo (FC) para realizar las fases 2 y 3 del presente estudio. Este extracto finalmente utilizado fue caracterizado inmunoquímicamente:
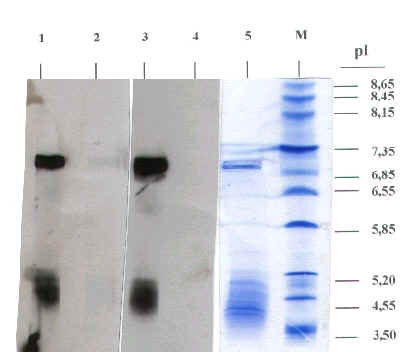
Comenzando por sus características físico-químicas, el extracto FC fue analizado en su composición de proteínas nativas separadas por punto isoeléctrico (pI) mediante técnica de Isoelectroenfoque en gel de agarosa. Se detectaron al menos 11 bandas proteicas (calle 5), la mayoría de las cuales mostró naturaleza acídica, con pI entre 5,20 y 3,50, detectándose también un par de bandas en la zona neutra, próxima al punto de aplicación de la muestra.
FIGURA 1

Figura 1. IEF-immunoblotting (ECL): Sueros humanos (1), Control (S. humanos) (2), Antisuero anti-Alt a 1 (3), Control (S. conejo) (4), Extracto FC (5).
Se encontraron proteínas fijadoras de IgE (calle 1) prácticamente en todo el rango de proteínas detectadas en el extracto. Cuando el immunoblotting fue revelado con un antisuero policlonal anti-Alt a 1 se pudo observar que la mayoría de bandas proteicas también eran capaces de fijar IgG específicas de este alergeno mayor, lo cuál era indicativo de la presencia de isoformas de Alt a 1 en el rango de pI 4,0-5,0 y de algún precipitado de dicho alergeno en el punto de aplicación de la muestra.
La caracterización de alergenos (proteínas fijadoras de IgE) se realizó por SDS-PAGE Immunoblotting. La Figura 2 muestra el resultado obtenido tras incubación con la mezcla de sueros de los pacientes estudiados y revelado cromogénico (anti IgE-peroxidasa/4-cloro-1-naftol). Se detectaron varias bandas intensas a pesos moleculares superiores a 25 kDa y una doble banda en torno a 15-16 kDa correspondiente a Alt a 1.
FIGURA 2
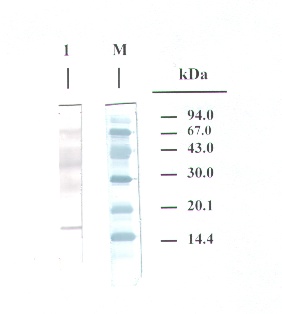
Figura 2. SDS-PAGE immunoblotting del extracto de A. alternata FC incubado con la mezcla de sueros de pacientes alérgicos a dicho hongo. (M): marcador de pesos moleculares, revelado con negro amido.
La determinación cuantitativa del alergeno mayor Alt a1 se efectuó mediante un ELISA comercial basado en el uso de anticuerpos monoclonales. El contenido de Alt a 1 del 2,1% en el total de proteínas del extracto se encontró comprendido en el margen de valores (2-5%) indicado por otros autores (Aden y cols., 1999).
Con todo lo anteriormente expuesto quedó definido el extracto a utilizar en las siguientes fases del estudio, correspondientes a la estimación de la dosis máxima tolerada (DMT) y a la realización del ensayo clínico.
A nivel de desarrollo experimental, y en paralelo al desarrollo del estudio, se está avanzando en la obtención de Alt a 1 recombinante con los objetivos de: diseñar un kit de ELISA propio con el que valorar el contenido de Alt a 1 en extractos y en muestras de polvo doméstico y para poder monitorizar la evolución de inmunoterapia en lo relativo a anticuerpos específicos de dicho alergeno. Ensayos preliminares del kit de ELISA han mostrado su equivalencia con respecto al sistema comercial.
Bibliografía