INMUNOTERAPIA ESPECIFICA CON
ALERGENOS DE LATEX (2ª PARTE)
SELECCION DE ALERGENOS
Domingo Barber, Manuel Lombardero, Santiago Martín, Pilar Rico
ALK-ABELLO S.A.
Madrid
INTRODUCCIÓN
Aproximadamente entre el 2 y 3% del látex natural son proteínas. Si
consideramos el porcentaje sobre peso seco, este tanto por ciento se duplica. Los productos procesados de látex, como los
guantes, pueden contener aún hasta un 3% de proteína.
La mayor parte de los trabajos
científicos publicados sobre la caracterización de alergenos de látex se han
realizado sobre látex natural. Este hecho es relevante porque, dado que la
utilización industrial del látex
implica siempre una estabilización previa, fundamentalmente por adición de
amoniaco, y la centrifugación y concentración de las partículas de caucho
natural, las composiciones proteica y alergénica del producto final sufren
cambios significativos respecto al látex natural.
La adición de amoniaco desnaturaliza y precipita varios componentes
proteicos. La centrifugación supone la eliminación de los lutoides (en el
llamado suero B) y la disminución de los componentes no asociados a las
partículas de caucho.
Figura 1: SDS-PAGE de extractos de látex. 1 y 2: extracto amoniacal. 3.- látex natural. 4.- Marcadores de peso molecular (se indica a la derecha en kDa)
Tal como se muestra en la figura 1, cuando comparamos los perfiles de proteínas de extracto amoniacal y de látex natural, mediante electroforesis en geles de acrilamida en presencia de SDS, se observan diferencias muy significativas. Mientras el extracto de látex natural presenta gran cantidad de bandas en un rango de pesos moleculares de 5 a >100 kDa de similar intensidad, en el extracto amoniacal no se detectan prácticamente bandas de alto peso molecular (> 60 kDa) y aparece una redistribución de bandas de bajo peso molecular con desapariciones de bandas de 20 kDa y aparición de nuevas proteínas de bajo peso molecular (alrededor de 6kDa).
Figura 2: IgE-Inmunodetección de extractos de látex. 1.- Látex natural. 2.- Control negativo. 3.- Extracto de guante de látex. 4.- Extracto amoniacal.
Si se realiza una inmunodetección de IgE con un pool de sueros de pacientes alérgicos a látex en los mismos
extractos y en un extracto de guante
(figura 2), observamos también diferencias significativas. Los perfiles
alergénicos del extracto amoniacal y del guante son bastante coincidentes. De
nuevo la banda de bajo peso molecular (6 kDa) parece ser la más relevante en el
extracto amoniacal. Además observamos dos bandas significativas aproximadamente
a 14 y 40 kDa respectivamente. En el caso del látex natural, el alergeno de 6
kDa se detecta débilmente, y aparece una banda de »20 kDa, que no aparece en el
extracto amoniacal y guante, y una serie continua de bandas de mayor peso
molecular. La proteína de 20kDa se ha identificado como proheveína. Esta
proteína se procesa durante el tratamiento amoniacal liberando un péptido de
6kDa, denominado dominio heveína, correspondiente a la región N-terminal de la proheveína.
El estudio de los alergenos del
látex se complica aún más por la existencia de panalergenos. Estas moléculas
pueden actuar como sensibilizantes primarios en el látex, pero también pueden
inducir IgE a través de otras fuentes alergénicas (por ej.: frutas y pólenes).
Estos panalergenos comunes al látex y a otras fuentes pueden explicar casos de
reactividad cruzada como por ej.: el conocido síndrome látex-frutas.
En los últimos años, la utilización de técnicas de biología molecular ha permitido la identificación y caracterización de más de 11 proteínas con actividad alergénica en el látex natural. La prevalencia a nivel de IgE varía ampliamente y lo que es más importante, varía también dependiendo del tipo de paciente: Profesionalmente expuesto y multioperado. No está claro si estas diferencias se deben al modo de presentación del alergeno, a una propiedad intrínseca de este o a una combinación de ambos. Quizás simplificando el panorama en exceso, el factor de elongación y su homólogo (Hev b 1/Hev b 3) se asocia principalmente con pacientes con espina bífida mientras que la proheveína/heveína (Hev b 6) es más relevante en pacientes profesionalmente expuestos. No obstante, existen alergenos como el Hev b 2 (b-1,3 glucanasa) y Hev b 5 (proteína ácida) que parecen ser relevantes en ambos grupos.
La existencia de panalergenos con secuencia conservada (principalmente quitinasas clase I y profilinas) en el látex natural y otras fuentes alergénicas de origen vegetal (pólenes y alimentos vegetales) ha permitido explicar la existencia de reactividad cruzada a nivel clínico en ciertos grupos de pacientes. Existe otro grupo de panalergenos, (b-1,3 glucanasas, enolasa, …) cuya importancia a nivel de reactividad cruzada no está todavía establecida.
Tabla I.- Alergenos
del látex
|
Alergeno |
NOMBRE |
MW |
AA |
Función |
Localización Subcelular |
Clasificación1 clínica |
|
Hev b 1 |
Factor de elongación |
14,6 |
137 |
Biosíntesis de la molécula de polisiopreno |
Partículas de caucho |
Mayoritario multioperados Relevante en trabajadores Hospital |
|
Hev b 2 |
b-1,3 glucanasa |
35,1 |
374 |
Proteína de defensa b-1,3 glucanasa |
Lutoides |
Relevante |
|
Hev b 3 |
Homólogo
factor elongación |
23-27 |
- |
Homólogo a Hev b 1 Síntesis del polímero |
Partículas de caucho de pequeño tamaño |
Mayoritario multioperados Relevante en trabajadores Hospital |
|
Hev b 4 |
Componente de Microhélice |
50-57 |
- |
Proteína estructural |
Lutoides |
Minoritario |
|
Hev b 5 |
Proteína ácida |
16 |
151 |
? |
Citoplasma |
Mayoritario |
|
Hev b 6 |
Preheveina Heveína |
20 4,7 |
187 43 |
Proteína de defensa Coagulación |
Lutoides |
Mayoritario |
|
Hev b 7 |
Patatina |
42,9 |
389 |
Proteína de defensa Esterasa |
Citoplasma |
Relevante |
|
Hev b 8 |
Profilina |
10,2-15,7 |
- |
Proteína del citoesqueleto Liga actina |
Citoplasma |
Minoritario |
|
Hev b 9 |
Enolasa |
51 |
|
Enolasa |
Citoplasma |
Minoritario |
|
Hev b 10 |
Superóxido dismutasa |
25,8 |
233 |
Superóxido dismutasa |
Mitocondria |
Minoritario |
|
Hev b 11 |
Quitinasa clase I |
|
|
Quitinasa |
|
Minoritario |
|
1Mayoritario > 60% pacientes sensibilizados Intermedio > 20% pacientes sensibilizados Minoritario < 20% pacientes sensibilizados |
||||||
CRITERIOS DE SELECCIÓN DEL EXTRACTO:
A la hora de seleccionar un extracto de látex hay que valorar primero las opciones existentes y analizar las ventajas e inconvenientes de cada una de ellas. Como veremos no existe una alternativa obvia.
Hemos
señalado anteriormente que las dos alternativas existentes son utilizar bien un
extracto natural de látex o un extracto estabilizado con amoniaco.
EXTRACTO NATURAL
Para
preparar un extracto natural de látex hay que recoger éste directamente del
árbol sobre un tampón adecuado y procesarlo rápidamente. Mediante
centrifugación y lavado de las distintas fracciones se obtienen los componentes
asociados a lutoides, partículas de caucho y suero.
El
extracto así preparado contiene todos los componentes proteicos del látex en
proporciones comparables según se observa en los patrones electroforéticos del
mismo.
El extracto natural no se utiliza nunca en la preparación de productos derivados de látex. Dada su extrema inestabilidad previamente a su utilización industrial el látex se estabiliza fundamentalmente por adición de diversas concentraciones de amoniaco. Dada la presencia de moléculas que actúan como panalergenos en un extracto natural, que pueden ser total o parcialmente eliminadas durante el tratamiento con amoniaco, se pueden obtener resultados inespecíficos o no relevantes clínicamente cuando utilizamos látex natural. Por otra parte el tratamiento con amoniaco supone la acumulación de diversos componentes proteicos que constituyen los componentes alergénicos más relevantes. Esto es especialmente obvio en el caso de la proheveína y la heveína. Ambas moléculas forman parte del alérgeno denominado Hev b 6. La heveína es de hecho la región N-terminal de la proheveína y se forma y concentra durante el procesamiento amoniacal. Las diferentes características físicas de estas dos moléculas podrían implicar diferentes perfiles farmacológicos (absorción, metabolismo....).
EXTRACTO AMONIACAL
El
proceso de preparación del látex para su uso industrial se inicia recogiendo el
látex del árbol sobre recipientes que
contienen amoniaco a fin de evitar la polimerización y contaminación
bacteriana. A continuación el producto se centrífuga para concentrar las
partículas de caucho. Los lutoides, y las proteínas asociadas a ellos son
eliminados, asimismo los componentes solubilizados en el suero ven reducida su concentración. Por otro lado las
proteínas asociadas a las partículas de caucho incrementan significativamente
su proporción relativa, e incluso algunas como la heveína, prácticamente
ausente en el látex de partida, se convierte en la molécula mayoritaria del
extracto.
Cuando
analizamos y comparamos los perfiles proteicos y alergénicos obtenidos de
suspensión amoniacal y de guantes, éstos coinciden. Es decir, que este extracto
es el responsable de la sensibilización primaria a látex.
Junto a
la heveína, la proteína ácida (Hev b 5) y la beta glucanasa (Hev b 2), parecen
ser los componentes relevantes tanto a nivel cuantitativo como en significación
clínica en el extracto. Mención especial merece el factor de elongación (Hev b
1). Esta proteína es probablemente la más abundante en el látex y está
íntimamente ligada a las partículas de caucho siendo esencial para la formación
de polímero. No obstante, su baja solubilidad hace que su concentración tanto
en extractos naturales como amoniacales
de látex sea baja y es posible que la eficacia diagnóstica para pacientes
monosensibilizados a Hev b 1 sea baja por diagnóstico cutáneo. De nuevo, las
propiedades físico-químicas del alergeno condicionan su perfil farmacológico,
mientras la molécula no es la más relevante como alérgeno en pacientes
sensibilizados por vía inhalatoria, consecuencia de su baja biodisponibilidad,
es el alérgeno mayoritario para pacientes multioperados en los que la
exposición al mismo se realiza a través de partículas de caucho o de almidón
depositadas en la herida y que liberarán el alérgeno posteriormente.
El resto
de los componentes alergénicos también están presentes en el extracto amoniacal
si bien su proporción relativa es mas baja que en el extracto natural.
PERFIL CLINICO DE AMBOS EXTRACTOS
Con el
fin de clarificar el comportamiento clínico de ambos extractos se procedió a
realizar la comparación de los dos en prueba cutánea en un grupo de 38
pacientes alérgicos a látex. El objetivo era valorar la potencia relativa de
ambos y los perfiles de sensibilidad y especificidad en la población estudiada.
La
mayoría de los pacientes incluidos eran trabajadores sanitarios aunque también
participaron trabajadores de la construcción y de la industria alimentaria y
pacientes multioperados. A todos ellos y a un grupo control de 25 sujetos no
atópicos se les realizó prick test, por duplicado, con cuatro diluciones 1/5 de
un extracto de látex amoniacal y natural, previamente estandarizado habiéndose
observado un contenido de 377 µg de proteina por 100 HEP.
La
relación de la actividad biológica entre ambos extractos se determinó mediante
ensayo de líneas paralelas. Ésta viene dada
por la distancia horizontal entre las rectas dosis-respuesta
correspondientes. La actividad biológica del extracto de látex natural fué 7.3
veces mayor que la del extracto amoniacal (figura 3).
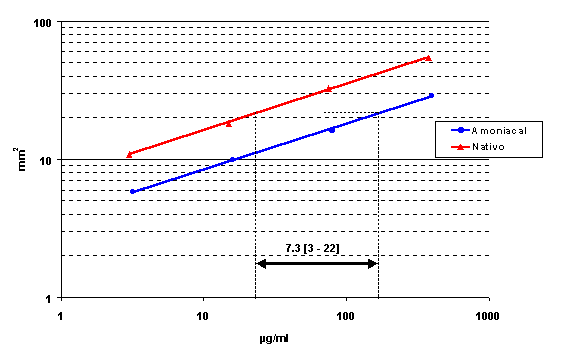
Figura 3. Comparación de la actividad biológica mediante PLA de un
extracto de látex natural y un extracto de látex amoniacal.
La sensibilidad del extracto de látex natural fué del 100% a la dosis máxima estudiada de 100 HEP/ml, reduciéndose al 92.1, 86.8 y 73.7% a 20, 4 y 0.8 HEP/ml con una especificidad del 100% excepto para la dosis de 100 HEP/ml que fué del 92% (figura 4). Los valores de sensibilidad del extraco amoniacal reflejaron la diferencia de actividad biológica, siendo ligeramente inferiores (figura 5) con la misma especificidad.
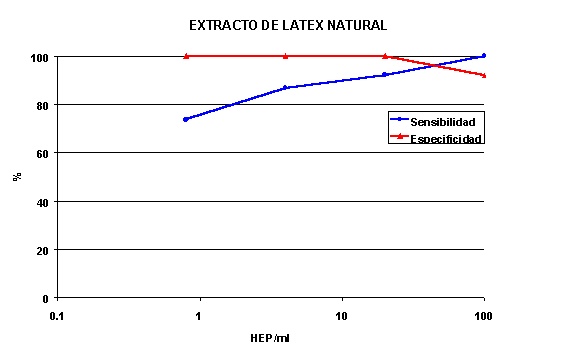
Figura 4. Sensibilidad y especificidad de un extracto de látex
natural.
.
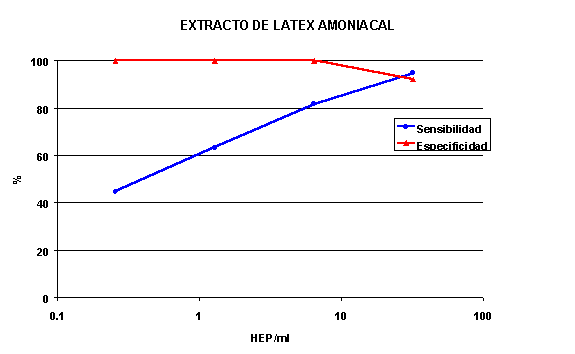
Figura 5. Sensibilidad y especificidad de un extracto de látex
amoniacal
Podemos concluir de este estudio que la
actividad específica del extracto de látex natural es 7 veces superior a la del
extracto amoniacal aunque ambos posean unas prestaciones diagnósticas similares
a las concentraciones de uso. La baja concentración de algunos alergenos en el
extracto amoniacal puede ser responsable de la disminución más abrupta de
sensibilidad a dosis bajas encontrada en este extracto en relación al natural.
DESCRIPCIÓN DEL EXTRACTO UTILIZADO
El Extracto utilizado en el presente estudio de inmunoterapia es un extracto depot, adsorbido a gel de hidróxido de aluminio, de látex natural estandarizado biológicamente en HEPs.
La equivalencia HEP a proteína es de 38 mg de proteína total para 10 HEPs.
La robustez del proceso de fabricación se comprobó fabricando cuatro lotes independientes, que se compararon, mediante SDS_PAGE, con la referencia de látex de la FDA, tal como se muestra en la figura.
En la tabla se muestra la actividad biológica, determinada mediante LIA de inhibición, de los mismos cuatro extractos fabricados, obteniendo un coeficiente de variación inferior al 8%
|
|
637302 |
707105 |
707106 |
707107 |
Media |
%CV |
|
Potencia (LIA-Inh) |
1.00 |
0.99 |
0.85 |
0.93 |
0.94 |
7.3% |
|
Proteína |
1.00 |
1.01 |
1.20 |
1.33 |
1.13 |
14.1% |
La estabilidad del extracto intermedio se comprobó tanto in vitro como in vivo, re-estandarizando el extracto utilizado al cabo de cinco
años. Se obtuvo un valor de 9,8HEPs para un valor teórico de 10HEPs.
BIBLIOGRAFÍA RELEVANTE
1.
Yamagi T, Sato M, Nakamura A, et
al. Plant defence-related enzymes as latex
antigens. J Allergy Clin Immnol 1998; 101:379-85.
2.
Yunginger JW, Jones RT, Fransway AF, et al. Extractable latex allergens an
proteins in disposable medical gloves and other rubber products. J Allergy Clin
Immunol 1994; 93:836-42.
3.
Leynadier F, Tran-Xuan T, Dry J. Allergenicity
suppression in natural latex surgical gloves. Allery 1991; 67:619-25.
4.
Dalrymple SJ, Audeley BG. Allergenic proteins
in dipped products: factors influencing extractable protein levels. Rubber
Developments 1992; 45:51-60.
5.
Palhories G. Reducing proteins in latex gloves.
The industrial approach. Clin Rev Allergy 1993; 11:391-402.
6.
Turjanmaa K, Alenius H, Mäjubeb-Kiljunen S, et al. Natural rubber latex allergy.
Allergy 1996; 51:593-602.
7.
Breiteneder H, Scheiner O. Molecular and
immunological characteristics of latex allergens. Int Arch Allergy Immunol
1998; 116:83-92.
8.
Poley GE, Slater JE. Latex allergy. J Allergy
Clin Immunol 2000; 105:1054-62.
9.
Kurup VP, Fink JN. The spectrum of immunologic
sensitization in latex allergy. Allergy 2001; 56:2-12.
10. Ebo D. IgE-mediated allergy from natural rubber latex. The UCB Institute
of Allergy.
11. Salcedo G, Díaz-Perales A, Sánchez-Monge R. The role of plant
panallergens in sensitization to natural rubber latex. Curr Opin Allergy Clin
Immunol 2001; 1:177-83.
12. Hoffman-Sommergruber K. Plant allergens and pathogenesis-related
proteins. Int Arch Allergy Immunol 2000; 122:155-66.