INHIBIDORES DE LAS
FOSFODIESTERASAS.
José Mª. Olaguibel Rivera
INTRODUCCIóN
La teofilina, un inhibidor no selectivo de las fosfodiesterasas de nucleóticos cíclicos (PDE), fue uno de los fármacos más utilizados en el tratamiento del asma bronquial. Las causas más importantes de la drástica disminución en su prescripción son tener una potencia broncodilatadora inferior a la de los b-adrenérgicos inhalados, presentar un margen terapéutico estrecho asociado a efectos secundarios importantes y por último, no haber sido catalogado como fármaco antinflamatorio. No obstante, ha aparecido un renovado interés en la farmacología y efectos clínicos de esta clase de fármacos, basado fundamentalmente por una parte en el incremento de nuestros conocimientos sobre las distintas isoenzimas de la PDE y el desarrollo de inhibidores selectivos de estas isoenzimas, y por otra en la demostración de la existencia de un amplio abanico de efectos clínicos de la teofilina más allá del mero efecto broncodilatador1, 2. En concreto, la teofilina tiene un efecto regulador a la baja de diversas funciones de células inflamatorias y del sistema inmune, en diversos modelos animales y es también capaz de modular la liberación de mediadores pro-inflamatorios3, y citoquinas como el TNF-a, la interleukina (IL) 1-B4 y reducir la producción de IL-2 por linfocitos T y la proliferación de linfocitos T dependiente de IL-25. Diversos estudios en pacientes asmáticos han demostrado que la teofilina reduce la reactividad bronquial frente a agentes directos como la metacolina, histamina6 o el dióxido de sulfuro7. Es capaz de inhibir la respuesta frente a agentes indirectos como soluciones hipotónicas8, y adenosina9, 10. Por último, la teofilina puede inhibir completamente el broncoespasmo inducido por el ejercicio a concentraciones plasmáticas inferiores a 15 mg/L11. Este efecto se mantiene en tratamientos prolongados8, 12.
Por otra parte, el pretratamiento con teofilina es capaz de modificar la respuesta bronquial frente a alergenos domésticos como ácaros13, 14, o frente a agentes ocupacionales como los isocianatos15, 16. En ambos casos es capaz de atenuar no solamente la respuesta inmediata, sino también, la respuesta de broncoconstricción tardía. Más aún, es capaz también de atenuar el incremento de la reactividad bronquial frente a metacolina 13, y el infiltrado eosinófilo de la mucosa bronquial asociados a estas respuestas tardías14, 16. También se ha descrito que la retirada de la teofilina en pacientes con asma grave, en tratamiento con corticoides, va seguida de un incremento en el número de linfocitos T en la vía aérea17. El tratamiento con este fármaco disminuye la actividad quimiotáctica natural para eosinófilos del esputo de pacientes asmáticos18 y los niveles de eosinófilos, en muestras de esputo inducido19.
Todos estos datos, en conjunto, apoyan un posible efecto antinflamatorio. Además, esta actividad antinflamatoria aparece a niveles plasmáticos bajos (< 10mg/L), de forma que los efectos adversos del fármaco estarían minimizados. En un estudio reciente, Barnes y colaboradores20 han demostrado que el tratamiento con dosis bajas de teofilina es capaz de reducir el infiltrado inflamatorio eosinofílico de la vía aérea de pacientes asmáticos, mediante el análisis citológico de muestras de esputo inducido y de biopsias bronquiales, sin observarse cambios en el funcionalismo pulmonar. Sin embargo, los niveles de óxido nítrico exhalado no se modificaron, una prueba más de la falta de paralelismo entre distintas técnicas de cuantificación de la respuesta inflamatoria bronquial.
FáRMACOS INHIBIDORES DE LAS
FOSFODIESTERASAS (PDE)
Isoenzimas de PDE
Sutherland y Rall describieron en 195821, la presencia de una actividad hidrolítica de
nucleótidos cíclicos, en una gran variedad de tejidos. Esta actividad
enzimática es capaz de terminar las acciones biológicas del c-AMP y del c-GMP,
muy bien conocidos como los denominados segundos mensajeros, envueltos en la
regulación de incontables procesos biológicos. Actualmente sabemos que una
amplia y diversa familia de enzimas denominadas PDE, es responsable de la
actividad hidrolítica de nucleótidos cíclicos descrita por estos autores. Se
han descrito hasta la actualidad nueve subfamilias de isoenzimas22. Todas poseen tres dominios funcionales y
presentan una homología estructural importante del núcleo central catalítico.
Sin embargo, tienen características de regulación y especificidades de
substrato muy distintas. Las familias principales son designadas numéricamente
y cada una de ellas tiene varios subtipos (tabla I). Las familias PDE4 y PDE7
son altamente selectivas para el c-AMP. La familia PDE3 aunque puede hidrolizar
ambos nucleótidos, funcionalmente se decanta por el c-AMP. El sustrato
preferido de PDE5 y PDE6 es el c-GMP, mientras que las familias PDE1 PDE2 hidrolizan de igual manera ambos nucleótidos.
TABLA I.
Características de las Fosfodiesterasas.
Familia
|
Isoenzima |
Subtipos |
Inhibidores selectivos |
|
1 |
Estimulada Ca2/CaM |
Tres |
Fenotiacinas Vipocetina |
|
2 |
Estimulada c-GMP |
Uno |
Eritroadenina |
|
3 |
Inhibida c-GMP |
Dos |
Milrinona Cilostazol Zardaverina |
|
4 |
Específicac-AMP |
Cuatro |
Rolipram Zardaverina CDP840 SB 207499 (Ariflo) Roflumilast |
|
5 |
Específica c-GMP |
Uno |
Dipiridamol Zaprinast |
|
6 |
Fotoreceptor |
Cuatro |
Dipiridamol Zaprinast |
|
7 |
Específica y alta afinidad
c-AMP |
Uno |
|
Una gran cantidad de estudios han demostrado que ambos
nucleótidos cíclicos c-AMP y c-GMP inducen la relajación del músculo liso bronquial,
mediante la vía clásica de las protein-kinasas23. Además de su efecto broncodilatador, el
c-AMP es un potente neuromodulador, regulando al alza el sistema inhibidor de
trasnmisión no adrenérgico no colinérgico (NANC). Puede también modular la
hipertrofia e hiperplasia del músculo liso bronquial, una de las
características más sobresalientes de la patología del asma bronquial. Por
último, es capaz de inhibir la actividad proinflamatoria de múltiples células
del sistema inmune, íntimamente ligadas a la patogenia del asma bronquial, como
son los mastocitos, eosinófilos, neutrófilos, monocitos o linfocitos24-28. La familia de fosfodiesterasas responsable
de la metabolización del c-AMP en todas estas células inflamatorias e
inmunocompetentes es fundamentalmente la PDE4 y en menor medida la PDE3 y PDE7,
esta última presente solamente en los linfocitos T28-31.
REGULACIóN DE LA ACTIVIDAD DE
LAS PDE. MECANISMOS E IMPLICACIONES TERAPéUTICAS.
Desde principios de los 70 era conocido que el
tratamiento de diversas células o tejidos con agentes capaces de incrementar el
contenido de c-AMP estimulaba un incremento de la actividad de las PDE. Existen
dos tipos generales de regulación22, 32. El primero denominado regulación a corto
plazo entraña la activación de las vías de segundos mensajeros y la
consiguiente modulación alostérica de la actividad enzimática. Este tipo de
modulación es efímero y cambiante de momento a momento. Por el contrario, el
segundo mecanismo denominado regulación a largo plazo, desarrolla su actividad
en un marco de tiempo prolongado y su reversibilidad es muy lenta una vez que
es eliminado el agente activador de la adenilato cilasa. Los mecanismos moleculares
de la regulación a largo plazo se fundamentan en un incremento de la síntesis
del enzima inducido por la activación de un gen promotor de tipo intron. Los
subtipos específicos de PDE4 que se regulan al alza aumentando su expresión
varían en los distintos tipos celulares.
Estas alteraciones en la expresión de la actividad de
PDE4 podrían influir tanto el tratamiento como en la fisiopatología del asma.
El uso regular de b-adrenérgicos podría
teóricamente regular al alza la actividad de la PDE4 en diversos tipos
celulares de la vía aérea. Este aumento de actividad podría reducir la
respuesta de estas células a activadores endógenos de la adenilciclasa
promoviendo un marco incontrolado de broncoconstricción y actividad
proinflamatoria.. Este tipo de mecanismos han sido señalados responsables de
diversos fenómenos como son el incremento de la respuesta bronquial al alergeno
o la tolerancia del efecto de protección también frente al alergeno, observados
tras el tratamiento continuado con salbutamol 23, 27, 29, 31, 33.
Con respecto a la fisiopatología, cualquier alteración
en la expresión de la PDE4 podría contribuir notablemente a modificar el
balance entre las vías endógenas pro y antinflamatorias. Habitualmente, los
activadores de la adenilato ciclasa como la adrenalina, PD2 y
prostaciclina actúan como agentes antinflamatorios endógenos. Teóricamente, un
incremento en la actividad de PDE4 podría conducir a una pérdida de
sensibilidad ante estos activadores endógenos, amplificando el proceso
inflamatorio asociado al asma y otras enfermedades alérgicas22, 23, 30, 31.
Inhibidores selectivos de las
isoenzimas de PDE.
En la tabla I se presentan algunos ejemplos de inhibidores selectivos. De todo lo comentado anteriormente se deduce que los inhibidores de la familia PDE4 podría ser potentes agentes antinflamatorios en el tratamiento del asma bronquial. En la tabla II se detallan las distintas acciones de inhibición de esta familia de isoenzimas PDE4 de la actividad proinflamatoria de múltiples células documentadas tanto “in vitro” como en experimentación animal. En contraste, los inhibidores de PDE4 poseen escasa actividad broncodilatadora “in vivo” si bien son capaces de actuar de forma sinérgica con los inhibidores de PDE3 previniendo el broncoespasmo desencadenado por histamina o LTD422, 28, 31.
Tabla II. Acciones de inhibición de los inhibidores de la PDE4 sobre células proinflamatorias y del sistema inmunológico.
|
Célula |
Familia PDE |
Efecto de inhibición |
|
Basófilos |
3 y 4 |
Histamina, Cys-LT |
|
Linfocitos B |
|
Síntesis de IgE |
|
Eosinófilos |
4 |
Expresión de CD11b O2 Quimiotáxis Degranulación |
|
Macrófagos |
3 y 4 |
TNFa |
Mastocitos
|
3 y 4 |
Histamina |
Monocitos
|
4 |
TNFa LTB4, Cys-LT |
|
Neutrófilos |
4 |
Adhesión LTB4, Lisozima MPO PAF |
|
Linfocitos T |
3, 4 y 7 |
Proliferación GM-CSF IL-2 IL-4 Il-5 IL-13 IFNg |
Los ensayos clínicos iniciales con la mayoría de los inhibidores de PDE4 como rolipram, fueron abandonados debido a la aparición de efectos secundarios importantes, fundamentalmente nauseas y vómitos.
Inhibidores
selectivos de PDE4 de segunda y tercera generación.
Parecía
posible que la aparición de efectos secundarios esté ligada a la inhibición de
un particular subtipo de PDE4. En concreto, la aparición de nauseas, vómitos y
la actividad psicotropa parecían ligadas al denominado locus de alta afinidad
para rolipram34. Siguiendo esta premisa se han desarrollado
los compuestos denominados de segunda generación con una menor afinidad para
este locus. Entre ellos se encuentran el CDP 840 y el SB207499
(Cilomilas/Ariflo GSK) el Rofumilast (Altana
Pharma) y su metabolito el RP 73401 (piclamilast).
En un
estudio doble ciego placebo, el CD840 demostró ser capaz de abolir la respuesta
tardía en la provocación bronquial con alergeno en un grupo de 15 asmático.
El SB207499
(Ariflo) se encuentra actualmente ya en fase III de investigación clínica35, 36. En un estudio de 6 semanas de duración doble
ciego frente a placebo mostró una tendencia a la mejoría de diversos parámetros
del funcionalismo pulmonar27. Este fármaco también ha demostrado ser
efectivo en el tratamiento de la enfermedad pulmonar obstructiva crónica
(COPD). En un estudio de más de 2000 pacientes ha demostrado un buen perfil de
seguridad37.
Otro potente inhibidor de segunda generación
también en desarrollo avanzado (fase III) es el Roflumilast (Altana Pharma)38.
Su estructura química derivada de la benzamida, se presenta en la figura 1. El
rofumilast es un inhibidor de PDE 4 altamente selectivo siendo incapaz de
afectar la actividad de otras isoenzimas de PDE, incluyendo PDE1, PDE2, PDE3 y
PDE5 incluso a concentraciones hasta 10.000 veces superiores. En diversos
estudios “in vitro” ha demostrado poseer un importante potencial
antinflamatorio e inmunomodulador inhibiendo la activación de neutrófilos,
eosinófilos o la síntesis en monocitos de TNF-a39. También ha demostrado ser eficaz en inhibir
las respuestas de broncoconstricción e inflamatoria tras la provocación con
alergenos en diversos modelos animales de asma bronquial40.
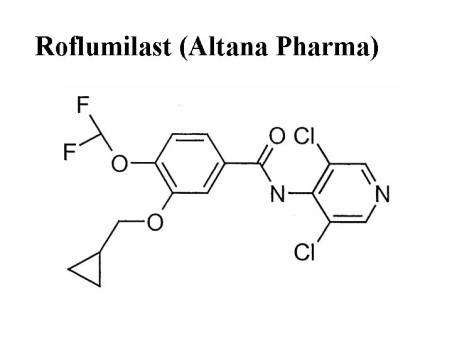
Figura 1. Estructura química
del Rofumilast.
En diversos
ensayos clínicos en voluntarios sanos el rofumilast ha demostrado poseer una buena
tolerabilidad y muy buenas propiedades farmacocinéticas en la dosificaciones
habituales entre 250- 1000 mcg, como son una alta biodisponibilidad del 80%, un
elevado volumen de distribución y una vida media situada entre 14 a 15 horas.
Todos estos datos apoyan una administración en dosis única diaria41.
Con respecto
al tratamiento del asma bronquial se ha demostrado una relación dosis respuesta
en ensayos clínicos en fase II, observándose respuestas mas significativas con
dosis de 500 mcg diarios, en un ensayo multicéntrico en que se incluyeron 680
pacientes42. En ensayos en fase III el tratamiento
continuado durante 12 semanas con 500 mcg diarios de rofumilast tenía una
eficacia terapéutica similar a la obtenida con beclometasona inhalada en dosis
de 200 mcg cada 12 horas, tanto en el control de síntomas como en los cambios
del funcionalismo pulmonar43. Por otra parte el pretratamiento durante una
semana con rofumilast fue capaz de inhibir significativamente las respuestas de
broncoconstricción inmediata y tardía
de forma dosis dependiente. Comparadas con el placebo la dosis de 250 mcg redujo de forma media el área bajo la curva
del descenso tardío del FEV1 en un 27% y la dosis de 500 mcg un 43%44. Significativamente rofumilast también parece
ser eficaz en el tratamiento de la rinitis alérgica45.
Por último se están desarrollando inhibidores selectivos de subtipos de
PDE4. En esta línea, el subtipo PDE4D parece estar especialmente involucrado en
la actividad inflamatoria de linfocitos T y eosinófilos, de forma que su
inhibición selectiva mantendría los efectos antinflamatorios con menos
posibilidades de desarrollar efectos
adversos. Desgraciadamente no se dispone en la actualidad, de datos clínicos de
estos inhibidores46, 47.
REFERENCIAS
1. MacLeod
D, Djukanovic R. Low-dose theophylline: a new anti-inflammatory role in asthma
management? Monaldi Arch Chest Dis 1996; 51:30-4.
2. Chung
KF. Theophylline in chronic asthma--evidence for disease-modifying properties.
Clin Exp Allergy 1996; 26 Suppl 2:22-7.
3. Sullivan
TJ, Parker CW. Pharmacologic modulation of inflammatory mediator release by rat
mast cells. Am J Pathol 1976; 85:437-64.
4. Spatafora
M, Chiappara G, Merendino AM, D'Amico D, Bellia V, Bonsignore G. Theophylline
suppresses the release of tumour necrosis factor-alpha by blood monocytes and
alveolar macrophages. Eur Respir J 1994; 7:223-8.
5. Bruserud
O. The effect of theophyllamine on T-lymphocyte activation in vitro. Clin
Immunol Immunopathol 1984; 32:111-8.
6. Magnussen
H, Reuss G, Jorres R. Theophylline has a dose-related effect on the airway
response to inhaled histamine and methacholine in asthmatics. Am Rev Respir Dis
1987; 136:1163-7.
7. Koenig
JQ, Dumler K, Rebolledo V, Williams PV, Pierson WE. Theophylline mitigates the
bronchoconstrictor effects of sulfur dioxide in subjects with asthma. J Allergy
Clin Immunol 1992; 89:789-94.
8. Fabbri
LM, Alessandri MV, De Marzo N, et al. Long-lasting protective effect of slow-release theophylline on asthma
induced by ultrasonically nebulized distilled water. Ann Allergy 1986;
56:171-6.
9. Holgate
ST, Mann JS, Cushley MJ. Adenosine as a bronchoconstrictor mediator in asthma
and its antagonism by methylxanthines. J Allergy Clin Immunol 1984; 74:302-6.
10. Cushley
MJ, Tattersfield AE, Holgate ST. Adenosine-induced bronchoconstriction in
asthma. Antagonism by inhaled theophylline. Am Rev Respir Dis 1984; 129:380-4.
11. Pollock
J, Kiechel F, Cooper D, Weinberger M. Relationship of serum theophylline
concentration to inhibition of exercise-induced bronchospasm and comparison
with cromolyn. Pediatrics 1977; 60:840-4.
12. Bierman
CW, Shapiro GG, Pierson WE, Dorsett CS. Acute and chronic theophylline therapy
in exercise-induced bronchospasm. Pediatrics 1977; 60:845-9.
13. Ward
AJ, McKenniff M, Evans JM, Page CP, Costello JF. Theophylline--an
immunomodulatory role in asthma? Am Rev Respir Dis 1993; 147:518-23.
14. Sullivan
P, Bekir S, Jaffar Z, Page C, Jeffery P, Costello J. Anti-inflammatory effects
of low-dose oral theophylline in atopic asthma. Lancet 1994; 343:1006-8.
15. Fabbri
LM. Effect of antiasthma drugs on asthmatic reactions induced by toluene
diisocyanate in sensitized subjects. Lung 1990; 168 Suppl:128-31.
16. Fabbri
LM, Maestrelli P, Saetta M, Mapp CE. Airway inflammation during late asthmatic
reactions induced by toluene diisocyanate. Am Rev Respir Dis 1991; 143:S37-8.
17. Kidney
J, Dominguez M, Taylor PM, Rose M, Chung KF, Barnes PJ. Immunomodulation by
theophylline in asthma. Demonstration by withdrawal of therapy. Am J Respir
Crit Care Med 1995; 151:1907-14.
18. Louis
R, Bettiol J, Cataldo D, Sele J, Henquet M, Radermecker M. Effect of a 4-week
treatment with theophylline on sputum eosinophilia and sputum eosinophil
chemotactic activity in steroid-naive asthmatics. Clin Exp Allergy 2000;
30:1151-60.
19. Aizawa
H, Iwanaga T, Inoue H, et al. Once-daily theophylline reduces serum eosinophil
cationic protein and eosinophil levels in induced sputum of asthmatics. Int
Arch Allergy Immunol 2000; 121:123-8.
20. Lim S,
Tomita K, Carramori G, et al. Low-dose
theophylline reduces eosinophilic inflammation but not exhaled nitric oxide in
mild asthma. Am J Respir Crit Care Med 2001; 164:273-6.
21. Torphy
TJ, Undem BJ. Phosphodiesterase inhibitors: new opportunities for the treatment
of asthma. Thorax 1991; 46:512-23.
22. Torphy
TJ. Phosphodiesterase isozymes. Molecular targets for novel antiasthma agents.
Am J Respir Crit Care Med 1998; 157:351-70.
23. Schudt
C, Gantner F, Tenors H, Hatzelmann A. Therapeutic potential of selective PDE
inhibitors in asthma. Pulm Pharmacol Ther 1999; 12:123-9.
24. Banner
KH, Page CP. Immunomodulatory actions of xanthines and isoenzyme selective
phosphodiesterase inhibitors. Monaldi Arch Chest Dis 1995; 50:286-92.
25. Doherty
AM. Phosphodiesterase 4 inhibitors as novel anti-inflammatory agents. Curr Opin
Chem Biol 1999; 3:466-73.
26. Nicholson
CD, Shahid M. Inhibitors of cyclic nucleotide phosphodiesterase
isoenzymes--their potential utility in the therapy of asthma. Pulm Pharmacol
1994; 7:1-17.
27. Schmidt
D, Dent G, Rabe KF. Selective phosphodiesterase inhibitors for the treatment of
bronchial asthma and chronic obstructive pulmonary disease. Clin Exp Allergy
1999; 29 Suppl 2:99-109.
28. Souness
JE, Aldous D, Sargent C. Immunosuppressive and anti-inflammatory effects of
cyclic AMP phosphodiesterase (PDE) type 4 inhibitors. Immunopharmacology 2000;
47:127-62.
29. Schudt
C, Tenor H, Hatzelmann A. PDE isoenzymes as targets for anti-asthma drugs. Eur
Respir J 1995; 8:1179-83.
30. Spina
D, Landells LJ, Page CP. The role of theophylline and phosphodiesterase4
isoenzyme inhibitors as anti-inflammatory drugs. Clin Exp Allergy 1998; 28
Suppl 3:24-34.
31. Spina
D, Landells LJ, Page CP. The role of phosphodiesterase enzymes in allergy and
asthma. Adv Pharmacol 1998; 44:33-89.
32. Torphy
TJ, Livi GP, Balcarek JM, White JR, Chilton FH, Undem BJ. Therapeutic potential
of isozyme-selective phosphodiesterase inhibitors in the treatment of asthma.
Adv Second Messenger Phosphoprotein Res 1992; 25:289-305.
33. Torphy
TJ. Action of mediators on airway smooth muscle: functional antagonism as a
mechanism for bronchodilator drugs. Agents Actions Suppl 1988; 23:37-53.
34. Dal
Piaz V, Giovannoni MP. Phosphodiesterase 4 inhibitors, structurally unrelated
to rolipram, as promising agents for the treatment of asthma and other pathologies.
Eur J Med Chem 2000; 35:463-80.
35. Torphy
TJ, Barnette MS, Underwood DC, et al. Ariflo (SB 207499), a second generation
phosphodiesterase 4 inhibitor for the treatment of asthma and COPD: from
concept to clinic. Pulm Pharmacol Ther 1999; 12:131-5.
36. Huang
Z, Ducharme Y, Macdonald D, Robichaud A. The next generation of PDE4
inhibitors. Curr Opin Chem Biol 2001; 5:432-8.
37. Hele DJ. New approaches to modulation of inflammatory processes in airway disease. Respir Res 2001; 2:e003.
38. Altana
Pharma Annual Report, 2001.
39. Hatzelmann
A, Schudt C. Anti-inflammatory and immunomodulatory potential of the novel PDE4
inhibitor roflumilast in vitro. J Pharmacol Exp Ther 2001; 297:267-79.
40. Bundschuh
DS, Eltze M, Barsig J, Wollin L, Hatzelmann A, Beume R. In vivo efficacy in
airway disease models of roflumilast, a novel orally active PDE4 inhibitor. J
Pharmacol Exp Ther 2001; 297:280-90.
41. Reid
P. Roflumilast Altana Pharma. Curr Opin Investig Drugs 2002; 3:1165-70.
42. Leichtl
S, Schmid-Wirlitsch C, Bredenbroker D, Rathgeb F, Wurst W. Roflumilast, a new,
orally active, selective phosphodiesterase 4 inhibitor is effective in the
treatment of asthma. Am J Respir Crit Care Med 2002; 165.
43. Albrecht
A, Leichtl S, Bredenbroker D, Bethke TD, Wurst W. Comparison of rofumilast, a
new, orally active, selective phophodiesterase inhibitor, with beclomethasone
dipropionate in asthma control, European respiratory Society Annual Meeting,
Stockholm. Sweden, 2002.
44. van
Schalkwyky EM, van Heerden K, Bredenbroker D, Leicht S, Wurst W. Dose-dependent
inhibitory effect of rofumilast, a new, orally active, selective
phosphodiesterase 4 inhibitor, on allergen-induced early and late asthmatic
reaction, European Respiratory Society Annual Meeting, Sockholm. Sweden, 2002.
45. Schmidt
BM, Kusma M, Feuring M, et al. The phosphodiesterase 4 inhibitor roflumilast is
effective in the treatment of allergic rhinitis. J Allergy Clin Immunol 2001;
108:530-6.
46. Barnes
PJ. New directions in allergic diseases: mechanism-based anti-inflammatory
therapies. J Allergy Clin Immunol 2000; 106:5-16.
47. Barnes
PJ. Potential novel therapies for chronic obstructive pulmonary disease.
Novartis Found Symp 2001; 234:255-67; discussion 267-72.