Inmunoterapia y apoptosis de linfocitos
J. Fernandez y A.Esteban.
Sección de Alergia y Unidad de Investigación
Hospital G.Universitario de Elche.
Introducción
La apoptosis en el sistema
inmunitario es un proceso importante que regula la maduración del linfocito,
selecciona los tipos de receptores y la homeostasis. La muerte por apoptosis es
esencial para la función de los linfocitos y para su crecimiento y
diferenciación[1].
Así, millones de linfocitos B son seleccionados en base a la
afinidad de los anticuerpos que presentan; Las células con una alta afinidad
por las proteínas derivadas de los tejidos propios son eliminadas. También, en
un segundo ciclo, tras la activación del linfocito por el antígeno específico,
son seleccionados, y se convierten en células plasmáticas[2].
En un proceso similar, los
linfocitos T son seleccionados en el timo, dependiendo de la afinidad de sus
receptores (TCR) por los antígenos del complejo mayor de histocompatibilidad
propio (MHC) clase I y II[3].
En un ejemplo típico, tras un ataque
por un agente infeccioso, las células presentadoras de antígeno (APCs)
presentan los péptidos antigénicos a los linfocitos T. Este proceso, con la
colaboración de ciertas citocinas, llevan a los linfocitos T a la expansión
clonal. Estos linfocitos T se comunican con otros T y B para regular la
respuesta. Después de la expansión, viene una fase de regresión en la cual la
mayor parte de los linfocitos son eliminados y quedan sólo los de memoria.
La apoptosis es la forma más común
de muerte de las células del sistema inmune[4].
Las rutas por las cuales esta apoptosis ocurre no son muy conocidas. En
principio, la muerte puede venir de la falta de estimulación de los receptores
específicos de los linfocitos, o por la
deprivación de citocinas tróficas (señales de proliferación), es decir, por la
ruta de los receptores de muerte o sistemas ligando-muerte. Es la llamada
muerte celular inducida por activación (activation-induced cell death, AICD).
La interleucina 2 (IL-2) juega un papel importante en este fenómeno, con un
doble cometido, ya que inicia el proceso clonal de expansión y, más tarde,
sensibiliza a los linfocitos T para la apoptosis[5].
El sistema CD95-CD95L parece desarrollar una importante
tarea en el inicio de la AICD y el sistema TNF-R2/TNF-a en la
fase más tardía[6]. Más aún, el
sistema perforina / GRANZIME B (GrB) también está envuelto en la AICD y puede
ocurrir de una manera independiente de caspasa.
Aparentemente las células T activadas tienen varias maneras
de morir; las cuales permanecen aún desconocidas.
Se han descrito las relaciones entre apoptosis y los tumores
linfoides, y otros desórdenes del sistema inmunológico como linfoadenopatías o
autoinmunidad con bastante profusión. También la relación entre apoptosis y
SIDA está siendo muy estudiada a nivel de los
receptores de los linfocitos T[7].
En lo que se refiere a los procesos apoptóticos relacionados
con la hipersensibilidad o alergia, hay menos investigado, centrándose
principalmente en los procesos inflamatorios que ocurren tras la respuesta
efectora de los linfocitos T en el asma o la dermatitis atópica.
Es conocido que en ambas enfermedades varios tipos celulares
se acumulan en la zona de la inflamación, ya sea en las vías aéreas (asma) o en
la piel (dermatitis atópica). De estas células destacan los eosinófilos,
mastocitos y linfocitos que tienen un papel central en el desarrollo de estas
enfermedades.
La acumulación de estas células activadas en el lugar de la
inflamación y la liberación de todos sus mediadores provocan los efectos
perjudiciales de estos procesos. Actualmente se admite que la desregulación de
los sistemas apoptóticos de estas células provocan una acumulación prolongada
de las mismas en los tejidos, lo que genera la inflamación crónica.
En esta línea, se sabe que los corticosteroides usados en el
tratamiento del asma inducen la apoptosis de los eosinófilos y linfocitos, con
lo que disminuye su permanencia en los tejidos, y por tanto la inflamación.
Con relación al resto de los procesos alérgicos hay muy poco
descrito, sobre todo en lo que se refiere a la respuesta efectora de los
linfocitos T y su conexión con los
linfocitos B productores de las IgEs, y de cómo ésta queda regulada por el
proceso de apoptosis.
La relación entre las diversas interleucinas (principalmente
Il-2, Il-4 y IFN-g) y
los mecanismos de apoptosis de los linfocitos T, se han estudiado
principalmente en leucemias.
Recientemente se ha lanzado la hipótesis de que existe una
relación entre la efectividad de la inmunoterapia en las enfermedades alérgicas
y la apoptosis inducida por este tratamiento (AICD) sobre las células T
efectoras (T4 ó T8). En los trabajos publicados por Guerra F. y col grupo
español de Córdoba, se sugiere que la inmunoterapia específica sobre pacientes
atópicos da lugar a una rápida apoptosis de los linfocitos T, en cultivo.[8]
Basados en la hipótesis anterior, nuestro grupo de trabajo
coincidiendo con un estudio “in vivo” de tolerancia y seguridad de
inmunoterapia específica con alergenos, ha determinado el grado de apoptosis en
células T por medio de Anexina V en pacientes atópicos sensibles a pólenes, a los cuales se les estaba tratando
con una pauta cluster de inmunoterapia específica.
Material y métodos
Como estudio piloto, se eligieron 11
pacientes alérgicos a los alergenos del estudio (Olea y Lolium). Además se
incluirán 3 sujetos sanos como grupo control. Una vez obtenidos los resultados
de las diversas pruebas de determinación de apoptosis, se reevaluará el número
de sujetos que deben participar en el estudio, calculando “n” de forma
estadística, para una potencia ß=0,80 de los test estadísticos, y un error a=0,05.
Se incluyeron los siguientes
sujetos:
- Enfermedad alérgica
respiratoria por sensibilización polen de olivo y/o de gramíneas (Lolium).
- Edad comprendida entre 18 y 50 años.
- Test cutáneo positivo (prick
tests a polen de olea o Lolium, 100 BU/ml >3mm de diámetro) y IgE
específica (clase 2 o superior) frente a los alergenos anteriores.
Se
excluyeron los siguientes sujetos:
- Embarazo
- Tratamiento con
inmunoterapia previo.
- Contraindicaciones para
administrar inmunoterapia.
- Pacientes que no cumplan con
el tratamiento por cualquier motivo.
Los
sujetos que cumplían los anteriores criterios se incluyeron en el estudio,
administrándoseles la inmunoterapia específica que en cada caso precisen de la
casa farmacéutica ALK Abelló (Pangramín ® Depot, extracto de Olea y/o Lolium).
La administración del preparado se efectúa por vía subcutánea. Las dosis se administrarán durante la pauta “CLUSTER” a razón de 2 dosis diarias, separadas 30 min, con un intervalo entre cada grupo de dosis de una semana, hasta alcanzar la dosis óptima, o dosis máxima tolerada, al mes del inicio del tratamiento (Tabla 1).
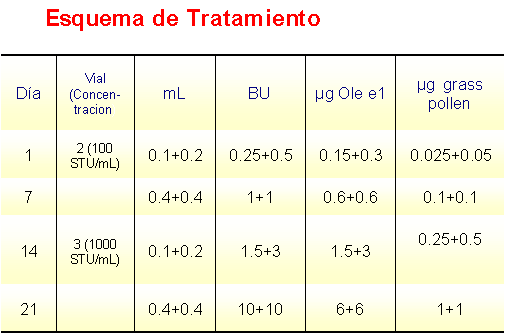
Para
el estudio de apoptosis, a todos los sujetos se les extrajo una muestra de
sangre antes de comenzar el tratamiento, que será utilizada para conocer los
valores basales, y otras muestras cada semana hasta alcanzar la dosis de
mantenimiento, aproximadamente al mes de iniciado el tratamiento, momento en el
que se alcanza la dosis máxima de la inmunoterapia. La muestra de sangre era en
1 tubo de sangre anticoagulada con EDTA para la separación de linfocitos.
Inmediatamente
después de la extracción se procede a la separación de las células mononucleadas
(PBMCs), por medio de gradiente de densidad con LIMPHOPREP 1,077 (Atom), centrifugando
las células 600 x g durante 30’. Posteriormente, tras 2 ciclos de lavado (400 x
g durante 5’) las células se resuspenden en medio de cultivo RPMI 1640 (GIBCO
BRL), suplementado con 10% de suero autólogo (pudiéndose sustituir por suero de
ternera fetal descomplementado o suero humano AB [GIBCO BRL]) y L-glutamina
(GIBCO BRL) 2mM.
Los
linfocitos así obtenidos fueron estudiados en todo caso por citometría de
flujo, realizándoseles la determinación de apoptosis por método de anexina V:
Método de la Anexina V. Durante los estadíos tempranos de la
apoptosis, una proteína ubicada en la cara interna de la membrana plasmática de
la célula, la fosfatidilserina, se transloca hacia su cara externa. Esta
proteina puede ser medida con la utilización de otra proteína, la Anexina V,
capaz de unirse selectivamente a la fosfatidilserina, formando un complejo estequiométrico. La utilización de
Anexina V unida a fluoresceína (Anexina V-FITC) nos permitirá la determinación
de la fosfatidilserina por fluorescencia, con lo que podemos determinar la
apoptosis por citometría de flujo de una manera sencilla.
Una vez separados, los linfocitos son lavados e incubados
con los marcadores celulares CD3, para diferenciar a los linfocitos T, y CD23,
para los linfocitos B. Tras un segundo lavado, se incubarán con anexina V-FITC
(DAKO), tras lo cual quedan listos para su determinación citofluorimétrica, en
el citómetro GALAXY (DAKO).
Resultados
Tras varias semanas de tratamiento, se objetivó un aumento
de los niveles de Anexina V a lo largo del tratamiento, en los linfocitos
totales y en los linfocitos T, mientras que no ocurrió así en los linfocitos B,
lo que nos lleva a sugerir que existe una relación entre la inmunoterapia y la
muerte celular específica inducida por este tratamiento, sobre los linfocitos
T, probablemente linfocitos T memoria (Figuras 1,2 y 3).
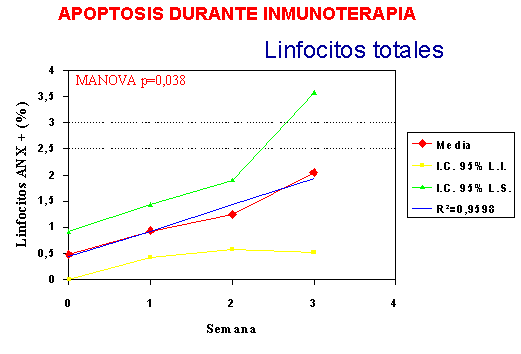
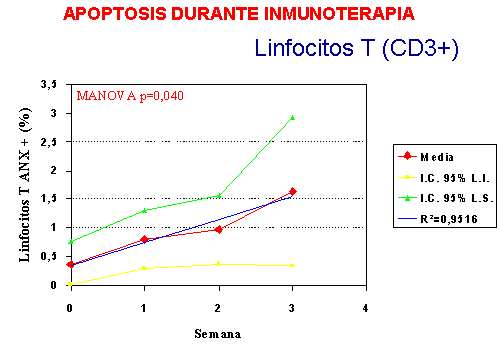
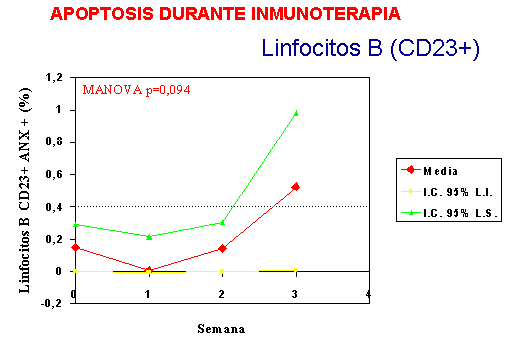
Conclusiones
Estos resultados “in vitro” sugieren que la apoptosis
inducida por los alergenos puede jugar un papel en el mecanismo de acción de la
inmunoterapia específica en sujetos atópicos, especialmente en la apoptosis de
los linfocitos T.
Esta apoptosis podría utilizarse como un parámetro de
respuesta inmune específica.
Futuro
Se pretende establecer
las condiciones óptimas de cultivo con alergenos específicos,
siguiendo los pasos de Guerra et al.8 , para determinar los
mecanismos de apoptosis inducida por los alergenos siguiendo:
a) Estudio de las rutas apoptóticas:
Caspasa, inhibidores,
Bcl-2, etc.
B) Determinar la especificidad antigénica de los linfocitos T que han entrado en
apoptosis mediante la selección positiva de estos.
También se pretende estudiar
la reproducción de los mecanismos de apoptosis en cultivo,
en
sujetos con inmunoterapia y correlacionar la respuesta
clínica con la apoptosis inducida
Para más adelante se pretende utilizar alergenos recombinantes en inmunoterapia y valorar la
respuesta inmune mediante la apoptosis inducida.
El conocimiento de estos procesos apoptóticos podrían
llevarnos al establecimiento de nuevas pautas más eficaces para la
inmunoterapia, o incluso, a través de inhibidores o estimuladores específicos
de rutas apoptóticas, al desarrollo de fármacos que mejorasen las enfermedades
alérgicas.